Inicio » Proyectos
Archivos de la categoría: Proyectos
La Universidad de Cádiz (UCA) ha dado un paso pionero en la investigación del cambio climático con la instalación de la primera torre Eddy Covariance en España dedicada al estudio del secuestro de carbono azul en ecosistemas intermareales.

Esta infraestructura forma parte del proyecto RICAS (Restoration and Rewilding of Saltmarshes as Nature-Based Solutions against Climate Change), financiado por los Fondos Europeos de Recuperación y Resiliencia (NextGenerationEU). El proyecto está dirigido por los doctores Alfonso Corzo y Sokratis Papaspyrou, del Departamento de Biología de la UCA.


Rewilding marino: restaurar para recuperar funciones ecológicas
Las marismas y salinas de la Bahía de Cádiz, como muchas otras zonas costeras europeas, han experimentado siglos de transformación por la actividad humana: salinas artesanales e industriales, acuicultura y uso agrícola.
El enfoque del rewilding —o “renaturalización”— busca revertir esta degradación restaurando las funciones ecológicas originales de los ecosistemas. En el marco de la nueva Ley Europea de Restauración de la Naturaleza, este tipo de acciones se reconocen como soluciones basadas en la naturaleza (NBS), fundamentales para frenar la pérdida de biodiversidad, mitigar la subida del nivel del mar y reducir los impactos del cambio climático.

Una infraestructura única en su género
La nueva torre Eddy Covariance permitirá medir en tiempo real los flujos de carbono, agua y energía entre la superficie de las marismas y la atmósfera. Gracias a esta tecnología de alta precisión, los investigadores podrán cuantificar el balance neto de carbono de distintos tipos de marismas —naturales, abandonadas o en proceso de renaturalización— con un detalle sin precedentes en España.
Estos datos reducirán las incertidumbres actuales en la estimación del secuestro de carbono azul, un elemento clave para comprender cómo las marismas contribuyen a la mitigación del cambio climático.

Ciencia, medio ambiente y futuro sostenible
El proyecto RICAS combina biogeoquímica, teledetección y modelización numérica en un enfoque interdisciplinar único. Un equipo de expertos en ecología costera, oceanografía física e ingeniería de datos trabaja de forma conjunta para ofrecer resultados con impacto científico, ambiental y socioeconómico.
Entre los principales objetivos del proyecto destacan:
- Mejorar la cuantificación y modelización de los flujos de carbono en marismas mareales.
- Desarrollar herramientas de gestión y restauración para el Parque Natural Bahía de Cádiz y otras zonas intermareales.
- Impulsar los mercados voluntarios de carbono azul, creando nuevas oportunidades para la conservación de humedales costeros.
- Alinear las políticas locales y nacionales con los objetivos europeos y de Naciones Unidas sobre biodiversidad y neutralidad climática.
“El seguimiento continuo del carbono en nuestras marismas nos permitirá entender su respuesta al cambio climático y diseñar estrategias eficaces para su recuperación”, afirma el Dr. Alfonso Corzo, investigador principal del proyecto.

Muestreo anual en la Bahia de Cádiz
En el marco del proyecto EXTREME-FUN, estamos investigando cómo la producción primaria bentónica, la biomasa de microfitobentos y la cantidad de carbono que se entierra o exporta del sistema varía a lo largo del año, y en diferentes puntos de la Bahía de Cádiz.
¿Cómo lo hacemos?
Utilizando una zodiac, que nos permite acceder a zonas poco profundas y de difícil acceso, recogemos 25 testigos de sedimento distribuidos por toda la Bahía y 15 más distribuidos en cada una de dos zonas opuestas con características diferentes (una arenosa, otra fangosa), lo que permite obtener una mayor resolución espacial.

Para escalar los datos obtenidos a una mayor resolución espacial, volamos al mismo tiempo drones equipados con cámaras multiespectrales y térmicas y coordinamos el muestreo con el paso del satélite SENTINEL 2.

Una vez finalizado el muestreo, transportamos todos los testigos de sedimento al laboratorio y medimos diversas variables biogeoquímicas como flujos de oxígeno, reflectancia, clorofila, tamaño de grano, etc.

¿Por qué lo estamos realizando?
Para estimar el efecto de eventos extremos, como olas de calor y tormentas, cada vez más frecuentes e intensos, sobre la biogeoquímica de los sedimentos intermareales, es esencial conocer las condiciones de base en la Bahía. Por lo tanto, este muestreo pretende incrementar los datos disponibles, permitiendo aumentar a escala a través de la detección, antes de estudiar los eventos extremos.
By : Sandra Rizzo Calderon
PID2020-112488RB-I00/ AEI / 10.13039/501100011033 «R&D Projects» 2020 – Modalities «Research Challenges» and «Knowledge Generation» // PI: Sokratis Papaspyrou /Alfonso Corzo (226.000 €)

Desvelando las estrategias microbianas en un océano cambiante: adaptación de los microrganismos a condiciones decrecientes de oxígeno
Una pequeña introducción…
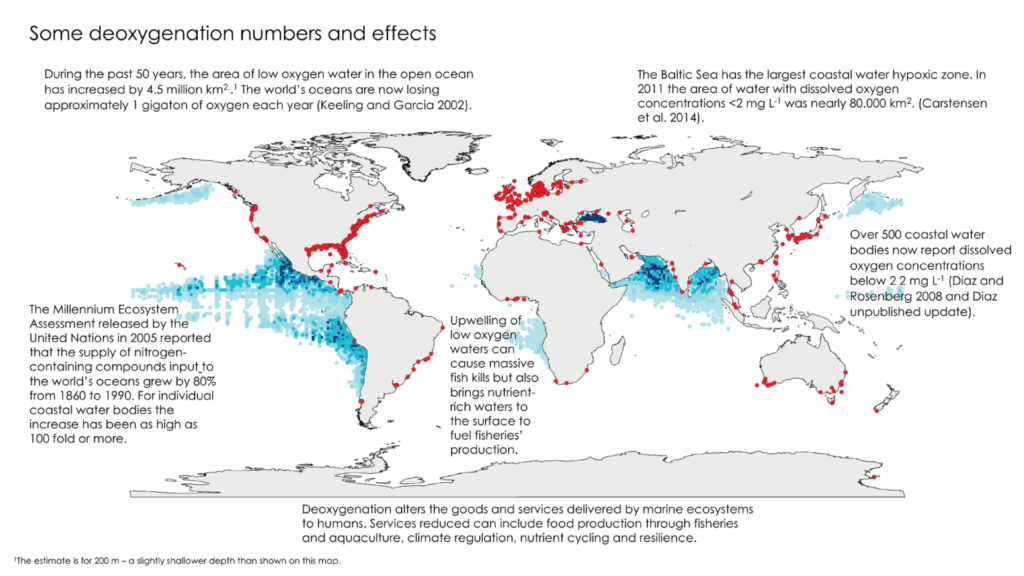
La desoxigenación de los océanos se considera como una de las amenazas más importantes que ocurren actualmente en los ecosistemas marinos, ya que los océanos han perdido aproximadamente un 2% de su oxígeno durante los últimos 50 años. Sin embargo, el impacto de la desoxigenación no solo ocurre en las zonas oceánicas, las zonas hipóxicas y anóxicas costeras están en aumento. Para tener una idea de la distribución de las áreas con bajo contenido en oxígeno, a continuación, se presenta un mapa global de Breitburg et al. (2016). Los puntos rojos hacen referencia a las zonas hipóxicas costeras (contenido en oxígeno disuelto <60 µM O2 kg-1), mientras que las zonas representadas con un degradado azul representan las zonas de mínimo de oxígeno.
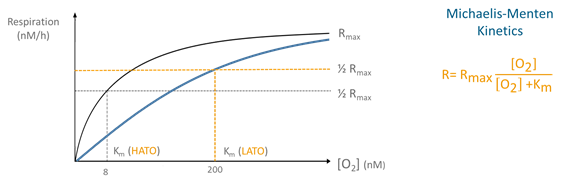
En consecuencia, los microrganismos tienen que hacer frente a estas condiciones decrecientes de oxígeno, pero, ¿cómo lo hacen? La respiración aeróbica se lleva a cabo mediante oxidasas terminales, un grupo de enzimas que juegan un papel fundamental en el último paso de la respiración aeróbica. Existen dos grupos de oxidasas terminales: oxidasas terminales de baja y alta afinidad (Low-affinity terminal oxidases/LATO, high-affinity terminal oxidases/HATO), con un valor de constante de semisaturación (Km) de 200 nmol O2 L-1 y 3-8 nmol O2 L-1, respectivamente. En contraste con los procariotas, que poseen únicamente oxidasas terminales de baja afinidad, los procariotas poseen tanto oxidasas terminales de baja como de alta afinidad. Los procariotas pueden usar ambos tipos de oxidasas terminales durante la respiración aeróbica para modular su afinidad por el oxígeno y, por tanto, adaptarse a condiciones decrecientes de oxígeno.
El modelo de cinética de Michaelis-Menten (imagen debajo del texto) puede utilizarse para estudiar el efecto de la concentración de oxígeno sobre las tasas de respiración y, por extensión, el comportamiento de la comunidad microbiana ante condiciones decrecientes de oxígeno. Los parámetros cinéticos, tasa de respiración máxima (Rmax) y la constante de semisaturación (Km) proporcionan una información general sobre el uso relativo de las diferentes oxidasas terminales y de las estrategias de adaptación empleadas por los microorganismos.
Este aumento en la extensión y distribución de las zonas deficientes en oxígeno, junto con su impacto en los ciclos biogeoquímicos a nivel global, hace imperativo un mayor conocimiento de los procesos microbianos que tienen lugar en dichas zonas. Así pues, la cinética de respiración aeróbica en medios con grandes gradientes de oxígeno nos ayudará a comprender la distribución de los microorganismos y sus procesos asociados que ocurren en la frontera óxica-anóxica.
Zonas de mínimo de oxígeno
Las zonas de mínimo de oxígeno son sistemas donde el hundimiento de materia orgánica producido por producción primaria en la superficie junto con una circulación lenta de las masas de agua conduce a la formación de masas de agua deficientes en oxígeno. La fuerte estratificación presente en las áreas tropicales hace que estas zonas de mínimo de oxígeno se extiendan ocupando amplias regiones, cubriendo casi 30 millones de Km2, lo que significa un 8% del total de la superficie de los océanos. Esto pone de manifiesto el importante papel que desempeñan estas zonas en la configuración de los ecosistemas marinos y de los ciclos biogeoquímicos, pero, ¿cómo?
Las OMZs desempeñan un papel esencial en el ciclo global del nitrógeno, en el que intervienen varias especies químicas y diferentes procesos bacterianos. Las OMZs están asociadas a la desnitrificación, un proceso que tiene lugar en regiones con deficiencia de oxígeno. Este proceso convierte el nitrato (NO3–), uno de los principales nutrientes del océano, en nitrógeno gaseoso (N en forma de nitrógeno molecular, N2, u óxido nitroso, N2O), que se pierde en la atmósfera y contribuye al déficit oceánico de nitrato.
Las OMZ no sólo intervienen en el ciclo del nitrógeno, sino también en otros procesos biogeoquímicos como la producción de sulfuro (H2S) y metano (CH4), así como en la limitación del secuestro de CO2 atmosférico por el océano.
El impacto de las OMZ también se extiende a la biodiversidad, ya que esta zona deficiente en oxígeno puede servir de refugio frente a la depredación para organismos especialmente adaptados a estos niveles de oxígeno.
Por esta razón, las zonas de mínimo de oxígeno son cruciales para el estudio de la cinética de respiración aeróbica. Estos gradientes naturales de concentraciones de oxígeno nos permiten investigar y estudiar cómo las diferentes comunidades de microrganismos se adaptan a distintos niveles de concentraciones de oxígeno en la columna de agua. Reproduciendo estas condiciones en incubaciones controladas podemos observar los cambios en las tasas de respiración a lo largo de diferentes gradientes de oxígeno, haciendo de las zonas de mínimo de oxígeno laboratorios naturales.
Estudio de la cinética de respiración
Para medir la cinética de respiración, llevamos a cabo una serie de incubaciones en botellas de cristal modificadas. Monitoreamos y seguimos la concentración de oxígeno a lo largo del tempo de incubación mediante el uso de sensores de oxígeno de alta resolución, lo que nos permite medir las tasas de consumo de oxígeno desde anoxia hasta saturación completa. Las botellas de incubación permanecen en oscuridad y se sitúan en un baño con temperatura controlada. El set-up del experimento se muestra en la imagen inferior.

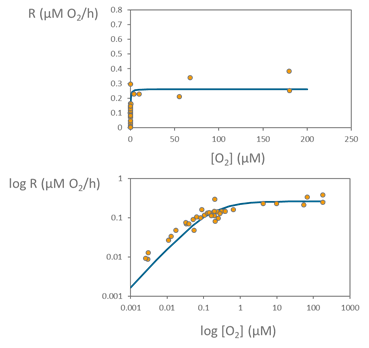
Utilizando los cambios en la concentración de oxígeno durante las incubaciones, podemos calcular las tasas de respiración a partir de regresión lineal de las concentraciones de oxígeno a lo largo del tiempo en las diferentes botellas con distintos niveles de oxígeno. Utilizando todas las tasas de respiración obtenidas en cada una de las botellas, podemos ajustar los datos al modelo de Michaelis-Menten y así caracterizar la cinética de respiración de la comunidad microbiana en cuestión, tal y como se puede observar en el siguiente gráfico.
Los puntos en el gráfico representan las tasas de consumo de oxígeno a lo largo del gradiente de oxígeno utilizado, desde valores muy bajos de oxígeno hasta saturación completa de oxígeno. La línea azul representa el modelo de Michaelis-Mente. Para una mejor visualización de los datos y su ajuste al modelo, se representa el gráfico en escala logarítmica, tanto para el eje de respiración como el de la concentración de oxígeno.
El trabajo detrás de las incubaciones
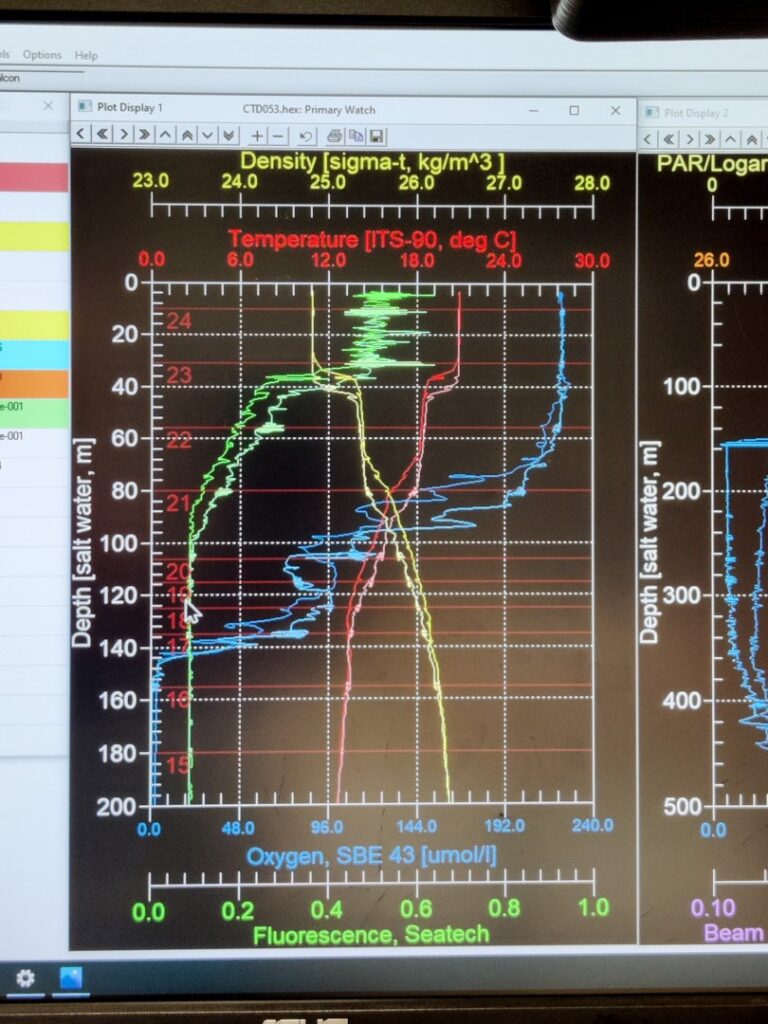
Antes de llevar a cabo las incubaciones, es esencial comprender las características físicas y químicas de la columna de agua. Para ello, utilizamos un sensor de conductividad-temperatura-profundidad, comúnmente conocido como CTD (del inglés, conductivity-temperature-depth). Este instrumento se usa ampliamente en el campo de la oceanografía para caracterizar los cambios en conductividad y temperatura con la profundidad. Los CTDs más modernos están equipados con sensores adicionales que miden datos de otros parámetros como concentración de oxígeno, fluorescencia (indicativo de la actividad del fitoplancton), turbidez, etc.

Los CTDs se encuentran anclados a una estructura metálica llamada roseta, la cual está formada por un conjunto de botellas que son utilizadas para recolectar agua de distintas profundidades. Las botellas pueden ser controladas remotamente desde una sala de control, donde los científicos reciben los datos en directo del CTD y pueden seguir los cambios en las características físicas y químicas de la columna de agua a medida que la roseta desciende. Una vez que la roseta comienza su retorno a la superficie, las botellas pueden ser cerradas remotamente a la profundidad seleccionada. Aquí tenéis un ejemplo: una roseta del R/V Atlantis (Woods Hole Oceanographic Institution, Massachusetts, E.E.U.U.). En concreto, esta roseta está compuesta por 24 botellas de 12 litros, aunque puede ser de distintos tamaños y tener más o menos botellas. El CTD está situado debajo del conjunto de botellas. Como medida de seguridad, la roseta siempre está anclada al suelo. El proceso de inmersión y recuperación del CTD puede llevarse a cabo por el equipo científico a bordo con las indicaciones del personal técnico, o puede ser controlado remotamente por un técnico, tal y como se muestran en las imágenes de abajo. Por otro lado, los científicos reciben la información del CTD y otros sensores asociados a tiempo real, lo que les permite tomar decisiones en cuanto a los experimentos o muestras a recolectar. Una vez que la roseta está en la superficie y asegurada en el suelo, el agua se obtiene directamente de las botellas mediante la conexión de un tubo al pitorro de la botella. El éxito de la recolección de muestras está en la colaboración entre científicos y técnicos.
Biocobre: Nuevo proyecto de MEBL
El grupo de investigación en Ecologia Microbiana y Biogeoquímica de la UCA (MEB-LAB) inicia el desarrollo de una nueva linea de investigación sobre la precipitación de cobre en ambientes contaminados por drenaje acido de minas en el marco del proyecto “Bioprecipitación de cobre metálico a partir de drenaje ácido de minas en la Faja Pirítica Ibérica» BIOCOBRE, financiado por la Junta de Andalucía.
El objetivo del proyecto es estudiar precipitados de sales y óxidos de cobre en ambientes contaminados por drenaje ácido de mina (AMD). Se investigarán las condiciones biogeoquímicas, la comunidad microbiana y las vías metabólicas implicadas en la precipitación de nanopartículas de cobre en biofilm que crece en zonas de drenaje ácido de mina (AMD) en la zona de la Faja Piritica Iberica (Huelva).
Los precipitados de sales y óxidos de Cu2+ y Cu+ son comunes en los ambientes contaminados por drenaje ácido de mina (AMD), pero no así los de Cu0. En BIOCOBRE se investigarán las condiciones biogeoquímicas, la comunidad microbiana y las vías metabólicas implicadas en la precipitación de nanopartículas de cobre metálico (Cu0) en un biofilm que crece en el drenaje ácido de mina (AMD) de la mina abandonada Mina Esperanza (Huelva). Para entender el proceso de bioprecipitación del Cuº, estableceremos los siguientes objetivos: 1) definir el ambiente geoquímico dentro del biofilm donde precipita el Cu0 y medir con precisión las tasas de precipitación de Cu0 en diferentes condiciones, 2) describir la evolución de la comunidad microbiana del biofilm desde la colonización hasta la madurez en diferentes condiciones ambientales, 3) aislar y cultivar los microorganismos del biofilm (principalmente hongos y bacterias) potencialmente implicados en el proceso de precipitación de Cu0. Para lograr estos objetivos, utilizaremos un enfoque multidisciplinar en el que combinaremos técnicas de vanguardia de diferentes disciplinas científicas: microsensores (O2, H2S, pH y Eh), métodos geoquímicos y mineralógicos, microscopía electrónica de transmisión de barrido (STEM), herramientas ómicas (metagenómica, metatranscriptomica, metaproteómica, metabolómica) y cultivos microbianos multiespecificos y axénicos. El impacto científico y socioeconómico de BIOCOBRE, si somos capaces de conseguir la precipitación de Cu0, podría ser elevado. Podría conducir a la obtención de patentes y probablemente abriría una nueva línea de investigación centrada en la bioingeniería del proceso de precipitación del Cu0, para convertirlo en una alternativa técnica y económicamente viable para recuperar el Cu0 del AMD, utilizando un enfoque ecológico a un coste reducido, en la que Andalucia estaría a la vanguardia.
En el proyecto colaboran investigadores de distintos departamentos y universidades:
Corzo Rodriguez, Alfonso, Dept Biología, Area de Ecología. Investigador principal, Coordinación general. Ecología microbiana
Papaspyrou, Sokratis, Dept Biología, Area de Ecología. Ecología microbiana.
García Robledo, Emilio Guillermo, Dept Biología, Area de Ecología. Ecología microbiana.
Duran Ruiz, Maria Del Carmen, Dept Biomedicina, Biotecnología y Salud Publica, Area de Bioquímica. Metaproteonómica.
Garrido Crespo, Carlos, Dept Biomedicina, Biotecnología y Salud Publica, Area de Microbiología. Aislamiento de microorganismos.
Lajaunie, Luc Cyrille Jacques, Dept de Ciencia de los Materiales e Ingeniería Metalúrgica y Química Inorgánica. Microscopia electrónica y análisis mineralógicos

Fig. 1. Salida del AMD de Mina Esperanza (Huelva) y canal de precipitación (A, E). Superficie del biofilm en el canal (B). Microsensor de O2 acoplado a un micromanipulador midiendo in situ (F). Porciones del biofilm con acumulaciones de Cu precipitado (color rosa) (C). Imágenes SEM de precipitación de Cu dentro de las masas rosadas con diferentes aumentos (D, G, H). El Cuº precipitado se encuentra en estrecha asociación con estructuras amorfas y filamentosas que podrían representar la matriz de EPS del biofilm y estructuras bacterianas como nanocables (nanowires) (H).
En el proyecto también participan:
Castillo Hernández, Julio Cesar. Univeridad de Free State, Sudafrica. Geomicrobiología, herramientas moleculares y microscopia.
Valverde Portal, Angel, IRNASA-CSIC. Microbiología.
Taylor, Joe Daniel, UK Centre for Ecology & Hydrology. Metagenómica.
El proyecto (P20-01048) está cofinanciado por la Unión Europea, en el marco del Programa Operativo FEDER Andalucía «Crecimiento inteligente: una economía basada en el conocimiento y la innovación, respondiendo también a la Estrategia de Investigación e Innovación para la Especialización Inteligente de Andalucía (RISˑAndalucía) y a las prioridades y objetivos previstos en el Plan Andaluz de Investigación, Desarrollo e Innovación (PAIDI 2020).